はじめに
平成14年度に農林水産省が牛凍結胚の受胎率を調査したところ,体内由来で46%なのに対し,体外由来だと36%という結果になりました。わが国の飼養頭数状況を考慮すると,新鮮胚にあわせて受胚牛を用意することは難しい状況にあると思われます。効率よく移植して産子を増やしていくためには,同期化した受胚牛にあわせた移植が必要であり,胚を長期間保存する技術は不可欠なものであると考えられます。
現在,移植現場で普及している緩慢凍結法では,性判別胚など胚の一部を切断したり,透明帯を失ったりした体外操作胚についてはうまく細胞内の水分を脱水することができず,残った水分が細胞内で凍結してしまい,胚に重大なダメージを与えてしまいます。また耐凍性が低いと言われている体外受精胚についても,緩慢凍結法では期待していたような胚の生存性や受胎率が得られないのが現状です。そこで,1985年にRallらが開発したのが「ガラス化法」です。この方法では,高濃度のガラス化液で胚を処理することで,急速に細胞内の水分を脱水させることができます。また,仮に脱水しきれなかったわずかな水分が細胞内に残っていたとしても,物理化学的に「凍結」した状態ではないため,胚が受けるダメージは皆無になると考えられています。
ガラス化法が開発されて以来,原法に改良を加えた方法が多数報告されています。そこで当センターでは,体外操作胚の長期間保存におけるガラス化の効果を,核移植胚および体外受精胚を使って調査しました。
方 法
基本となるガラス化法ですが,2000年にDinnyesらが報告したSolid Surface Vitrification(以下,SSV法)を採用しました。SSV法は図1のように,極低温に強い,熱伝導率が高い,毒性がないなどの特性をもつアルミニウムの特徴を生かし,アルミホイルでカバーしたメタルキューブを液体窒素で冷却し,その表面に胚を含んだ1〜2μlのガラス化液を落としてガラス化する方法です。今回われわれは,アルミホイルやメタルキューブの変わりに,アルミニウム製のプレートを代用し,「アルミプレートガラス化法」と命名しました。
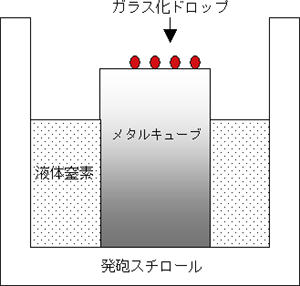
図1:Solid Surface Vitrification法の模式図
(Dinnyes A,Biol Reprod 63:513-518,2000 FIG.1改)
この方法の利点としては,大きく3つ考えられます。1つ目は,ドロップを直接液体窒素中に落とすのではなく,冷却されたアルミプレート上に落としますので,ドロップが瞬間的にボイルした際に生じる窒素ガス層が形成されにくく,冷却速度が向上します。またドロップが微量であるため,融解速度も向上します。これらのことは,ガラス化液の毒性や透明帯の損傷から回避するにも有効です。2つ目に,胚の衛生的な取り扱いが可能となります。ドロップをアルミプレート上に落としますので,アルミプレートを消毒でき,また液体窒素中に含まれる細菌や不純物などによる汚染を回避できます。最後に,ガラス化するにあたり特殊な機械を必要としませんので,安価に胚を保存することができます。
さて実際の方法ですが,まず発泡スチロール内に液体窒素を入れ,消毒したアルミプレートを冷却しておきます(図2)。ガラス化する胚は,平衡液で3分間,ガラス化液で20秒間平衡します。
|
各メディウムは牛胎児血清を20%加えた199Aが基礎となっており,平衡液には4%エチレングリコールが,ガラス化液には35%エチレングリコール,5%ポリビニールピロリドン,0.4Mトレハロースが含まれています。次にドロップの準備ですが,胚を含んだガラス化液を,先端を細くしたガラスピペットで吸引し,1〜2μlになるようにピペット先端に出します。

図2:アルミプレートの準備
発泡スチロール内に液体窒素を入れ、アルコールで消毒したアルミプレートおよびクライオチューブを冷却しておく。
次に,発泡スチロールの縁に手首を勢いよく当て,その衝撃によってドロップをアルミプレート上へ落とします(図3)。落ちたドロップは,ボイルすることなく素早く冷却され,球状を保ってガラス化されます(図4)。最後に,あらかじめ冷却してあるクライオチューブにドロップを入れ,液体窒素中に保存します。融解方法ですが,融解液には0.4Mトレハロースが含まれていますので,2倍階段希釈し,1分間ずつ平衡させます。 融解された胚を確認した後,培養を行います。

図3:アルミプレートへの落下
発泡スチロールの縁に手首を勢いよく当て,
その衝撃によってドロップをアルミプレートへ落とす。

図4:アルミプレート上に落ちたドロップ
落ちたドロップは素早く冷却され、球状を保ってガラス化される。
|





